Периоперационная анемия
Достаточно широко известны все аспекты негативного влияния анемии на организм человека. Однако среди пациентов с анемией выделяют особую группу пациентов, нуждающихся в пристальном внимании, — пациентов с анемией, которым предстоит оперативное вмешательство.
- Анемия перед операцией
- Анемия после операции
Актуальность
Достаточно широко известны все аспекты негативного влияния анемии на организм человека. Однако среди пациентов с анемией выделяют особую группу пациентов, нуждающихся в пристальном внимании, — пациентов с анемией, которым предстоит оперативное вмешательство.
Проведено несколько эпидемиологических исследований, в которых было показано, что распространенность анемии у хирургических пациентов в предоперационном периоде значительно выше, чем в общей популяции и может достигать, по данным разных исследований, 75,8%8. Также следует отметить, что в структуре всех анемий до 80% приходится на долю ЖДА9.
Однако, несмотря на такую высокую распространенность, анемия у пациентов, готовящихся к плановым хирургическим вмешательствам, по-прежнему остается недооцененной в плане потенциальных рисков как в ходе операции, так и в послеоперационном периоде.
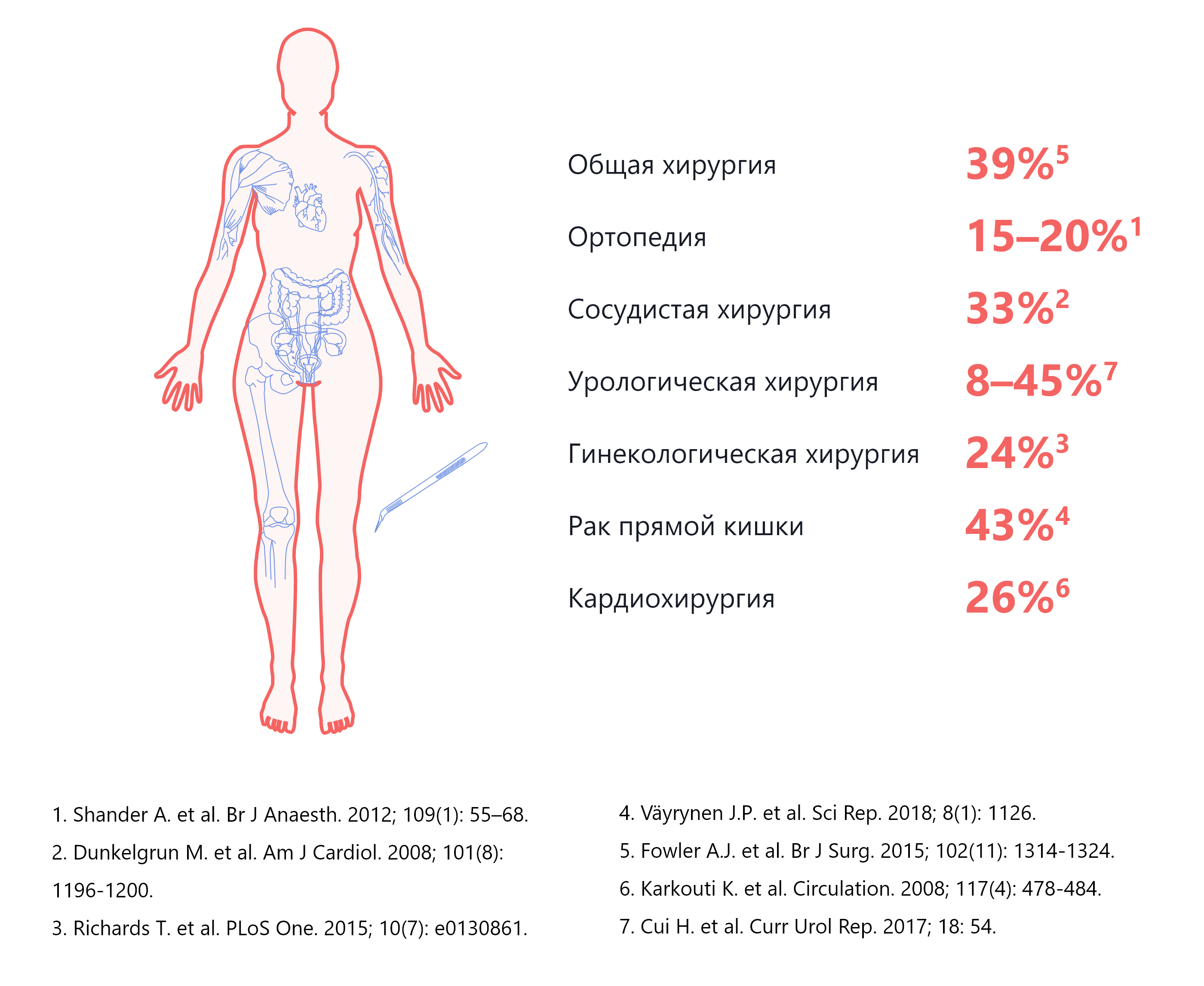
Предоперационная анемия часто встречается во всех группах хирургических вмешательств1-7
Последствия и риски
Фоновая предоперационная анемия, как сама по себе, так и усугубленная периоперационной кровопотерей, способствует увеличению потребности в гемотрансфузиях, которые в свою очередь несут дополнительные риски для пациента и так находящегося в уязвимом положении1. Анемия в предоперационном периоде оказывает негативное влияние на летальность в послеоперационном периоде, ассоциируется с повышенным риском острого повреждения почек, развития инфекций, инсультов.
По сравнению с пациентами без исходной анемии частота гемотрансфузий у пациентов с предоперационной анемией была больше [отношение шансов — odds ratio (OR) 4,7, 95% доверительный интервал (ДИ) 3,8–5,8)2,3. Анемия в предоперационном периоде оказывает негативное влияние на летальность в послеоперационном периоде. Послеоперационная 30-дневная летальность пациентов даже с легкой анемией (OR 1,41, 95% ДИ 1,30–1,53) и тем более со среднетяжелой или тяжелой анемией (OR 1,44, 95% ДИ 1,29–1,60) была выше, по сравнению с аналогичным показателем у пациентов без анемии в предоперационном периоде4. Метаанализ взаимосвязи между предоперационной анемией и летальностью после оперативного лечения, проведенный на основе анализа данных 949 445 пациентов, включенных в 24 исследования, показал, что анемия ассоциировалась с повышенным риском смерти во время и после операции, а также повышенным риском острого повреждения почек, развития инфекций, инсультов, необходимости гемотрансфузий5. Существуют убедительные доказательства того, что среднетяжелая и тяжелая анемия (Hb менее 90 г/л) приводит к худшим исходам и коррекция анемии путем переливания эритроцитной массы может отрицательно сказаться на результатах операции6-8.
Анемия на предоперационном этапе ассоциируется с:

в 2,9 раза
более высокой вероятностью смертности
(ОШ = 2,9, ДИ 95% 2,30–3,68, P<0,001)9

22%
более длительным пребыванием в больнице
(11 в сравнении с 9 днями, P = 0,001)10

в 3,75 раза
более высокой вероятностью повреждения почек
(ОШ = 3,75, ДИ 95% 2,95–4,76, P<0,001)9

в 1,93 раза
более высокой вероятностью инфекции
(OШ = 1,93, ДИ 95% 1,17–3,18, P = 0,01)9

в 5,04 раза
более высоким риском трансфузии
(OШ = 5,04, ДИ 95% 4,12–6,17, P < 0,001)9
ДИ — доверительный интервал, ОШ — отношение шансов.
ЖДА у хирургических пациентов
ВОЗ определяет анемию как концентрацию Hb менее 130 г/л у мужчин, менее 120 г/л у небеременных женщин и менее 110 г/л у беременных женщин1. Эти определения широко цитируются, принимаются и используются в большинстве эпидемиологических исследований.
Говоря о предстоящем оперативном вмешательстве, следует отметить, что у женщин объем циркулирующей крови меньше, чем у мужчин, а одни и те же процедуры, выполняемые у обоих полов, часто приводят к сопоставимым объемам кровопотери. Следовательно, потеря крови в виде доли от объема циркулирующей крови пропорционально больше у женщин, и это может приводить к большим объемам переливания эритроцитной массы, что подтверждается исследованиями в области ортопедической хирургии2,3 и первым сравнительным исследованием, проведенным в Австрии4. Поскольку женщинам с предоперационной концентрацией Hb 120 г/л в 2 раза чаще требуется переливание эритроцитной массы, чем мужчинам с концентрацией Hb 130 г/л, концентрацию Hb 120 г/л следует считать субоптимальной в условиях хирургического вмешательства. Так, в кардиохирургии было показано, что снижение концентрации Hb на 10 г/л независимо ассоциировано с повышенной необходимостью в переливании эритроцитной массы, более высокой летальностью и увеличением продолжительности госпитализации5. Уровень убедительности рекомендаций I, уровень достоверности доказательств — A.
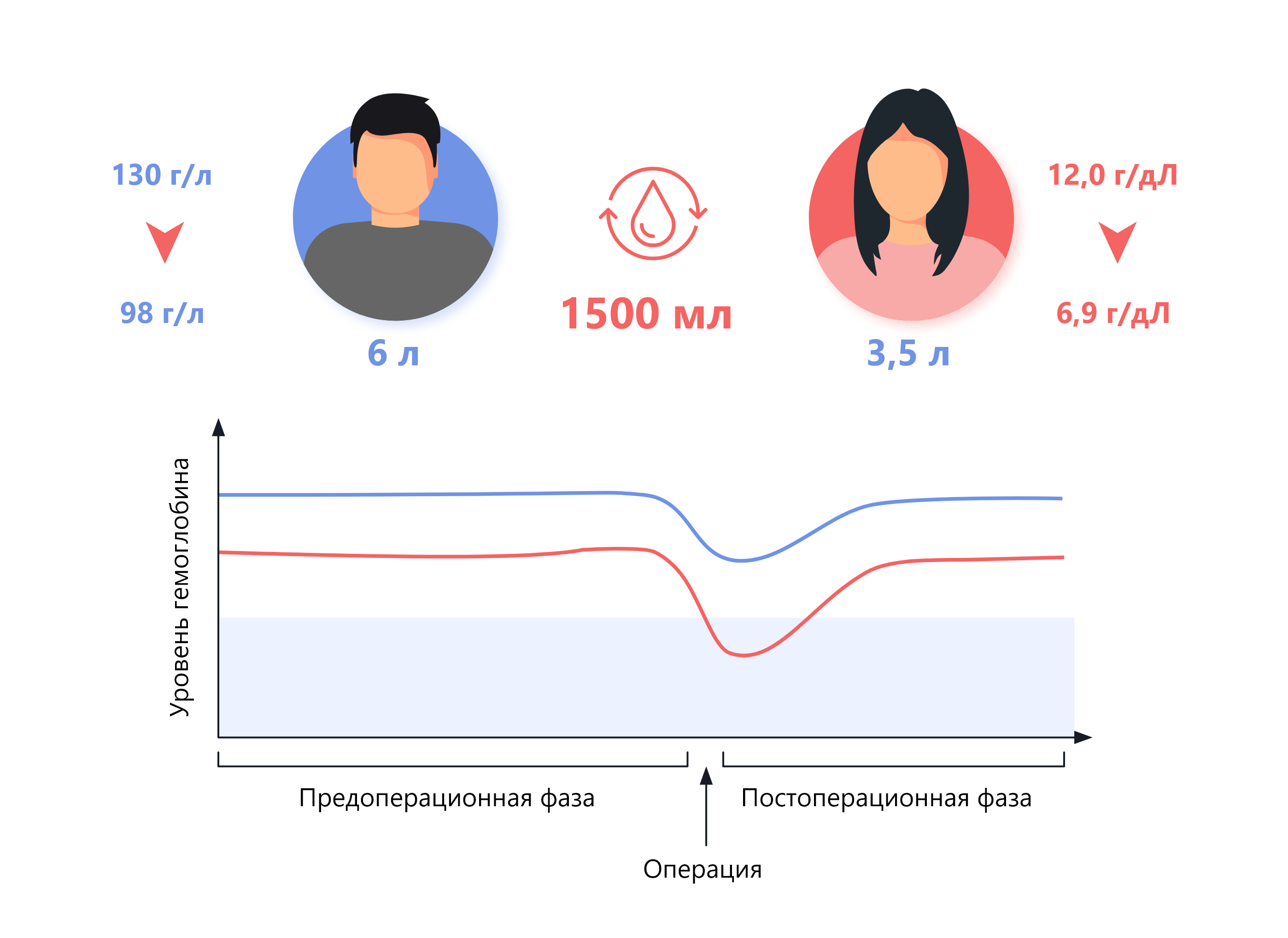
Следовательно, предоперационное лечение ЖДА должно быть направлено на достижение целевой концентрации Hb 130 г/л и более у обоих полов, чтобы минимизировать риск неблагоприятных исходов, связанных с переливанием эритроцитной массы6.
ДЖ у хирургических пациентов
ДЖ в организме является наиболее частым и широко распространенным дефицитом и затрагивает приблизительно 2 млрд человек во всем мире1,2. ДЖ с анемией или без нее выявляется у больных хроническими заболеваниями, такими как онкологические (у 43% пациентов), воспалительные заболевания кишечника (у 45% пациентов), хроническая болезнь почек (у 24–85% пациентов), хроническая сердечная недостаточность (у 43–100% пациентов) и другие хронические воспалительные процессы3.
Кроме общепризнанной роли в эритропоэзе, железо также является важным компонентом во многих клеточных процессах, таких как транспорт кислорода, перенос электронов, митохондриальное дыхание, регуляция экспрессии генов и клеточный иммунитет4. Функциональный ДЖ у пациентов в критическом состоянии влияет на продолжительность и тяжесть синдрома системной воспалительной реакции, длительность пребывания в отделении интенсивной терапии5.
При застойной сердечной недостаточности ДЖ связывают с ухудшением физической работоспособности и качества жизни6, с увеличением летальности общей и от сердечно-сосудистых заболеваний7-10.
У большой группы пациентов с внесердечными хирургическими вмешательствами (n=2115 из них 48% женщин) распространенность анемии составляла 34%, из них 75% случаев анемии были обусловлен абсолютным ДЖ и секвестрацией железа11.
Основным показателем, отражающим запасы железа в организме является сывороточный ферритин (СФ). Было показано, что низкая концентрации СФ перед крупными ортопедическими или абдоминальными операциями ассоциировалась с увеличением частоты послеоперационных инфекций и гемотрансфузий12. Harju E. Empty iron stores as a significant risk factor in abdominal surgery. Journal of Parenteral and Enteral Nutrition 1988; 12: 282-5. 13. Izuel-Ramí M., García-Erce J.A., Gómez- Barrera M. et al. Relación entre la transfusión de sangre alogénica, la deficiencia de hierro y la infección nosocomial en pacientes con fractura de cadera. Medicina Clínica (Barcelona) 2008; 131: 647-52. 14. Гречанюк Н.Д. и др. Анализ влияния предоперационной анемии на частоту трансфузий эритроцитов при эндопротезировании крупных суставов. Анестезиология и реаниматология. 2018; 63(2): 113-118.12,13,14.
Количество железа, необходимое для ежедневного производства 300 млрд эритроцитов (20-30 мг), обеспечивается главным образом макрофагами, перерабатывающими железо из стареющих эритроцитов, в то время как ежедневная абсорбция железа (1-2 мг) лишь уравновешивает ежедневные физиологические потери. Повышенная потребность в железе, ограниченное поступление из внешней среды и повышенная кровопотеря могут привести к прогрессирующему ДЖ и, как следствие, к ЖДА15,16.
Основные причины дефицита железа17
| А. Повышенная потребность |
|---|
| Рост в младенческом и детском возрасте |
| Лечение эритропоэз-стимулирующими агентами |
| В. Недостаточное поступление в организм |
| Недостаток в рационе питания |
| Неправильная диета с дефицитом биодоступного железа |
| Мальабсорбция |
| Резекция желудка |
| Инфекция Helicobacter pylori (даже без значительного кровотечения) |
| Синдромы мальабсорбции (болезнь Крона и целиакия) |
| Лекарственные взаимодействия (антацидные и антисекреторные препараты) |
| С. Увеличение потери |
| Флеботомия |
| Донорство крови |
| Диализ (особенно гемодиализ) |
| Кровотечение |
| Хирургическое вмешательство |
| Травма |
| Желудочно-кишечное кровотечение |
| Урогенитальное кровотечение |
| Кровотечение из респираторного тракта |
Согласно классификации, у пациентов хирургического профиля обнаруживаются различные типы (стадии) ДЖ.
Характеристика различных стадий ДЖ у хирургических пациентов17
| Статус железа | Лаборатоные показатели |
|---|---|
| Низкие запасы железа (для операций с умеренной или большой кровопотерей) | СФ менее 100 мкг/л |
| ДЖ | СФ менее 30 мкг/л * СФ 30–100 мкг/л НТЖ менее 20% и/или С-РБ более 5 мг/л |
| Функциональный ДЖ* | СФ 100–500 мкг/л НТЖ менее 20% |
| Секвестрация железа* | СФ более 100 мкг/л НТЖ менее 20% и/или С-РБ более 5 мг/л |
- Недостаточные (низкие) запасы железа в депо, в связи с этим неспособность организма поддерживать эритропоэз для восстановления после кровопотери во время операции. На это указывает сниженная концентрация СФ.
- Истинный (абсолютный) ДЖ без анемии — снижение концентрации железа в организме при нормальной концентрации Hb, когда концентрация железа в эритроцитах все еще достаточна для эритропоэза. Такое состояние часто наблюдается у женщин детородного возраста. ЖДА является наиболее тяжелым состоянием, при котором уменьшение запасов железа приводит к снижению концентрации Hb.
- Функциональный ДЖ — состояние, сопровождающееся недостаточной мобилизацией железа из депо при повышенной потребности на фоне наличия нормальных или повышенных запасов железа. Четко определяется у пациентов с заболеваниями почек после лечения эритропоэз-стимулирующими препаратами18.
- Секвестрация железа — состояние, сопровождающееся мобилизацией железа из депо в печени и макрофагах в связи с его недостаточностью для покрытия ежедневных потребностей костного мозга. Это вызвано воспалением, при котором активируется синтез гепцидина в печени, а также могут снижаться синтез и активность эритропоэтина. Гепцидин связывается с ферропортином — протеином, экспортирующим железо через мембраны клеток, и способствует его дезактивации и деградации, что приводит к ингибированию всасывания железа в кишечнике и секвестрации железа в печени и макрофагах15. Это может привести к истинному дефициту железа у пациентов с воспалением и хронической кровопотерей.
Рекомендации
Рекомендации для лучшей клинической практики: основные положения1.
- Предоперационную анемию и ДЖ следует рассматривать как важный компонент периоперационного периода, который начинается с принятия решения об операции до полного послеоперационного восстановления.
- Анемию и ДЖ необходимо лечить при всех хирургических вмешательствах с прогнозируемой умеренной или большой кровопотерей (более 500 мл).
- Диагностику и лечение анемии и ДЖ следует начинать как можно раньше в предоперационном периоде, идеально сразу же после принятия решения о проведении операции. При плановых операциях диагностика и лечение ЖДА являются обязательным этапом подготовки.
Виды хирургических вмешательств, при которых целесообразно проводить предоперационную оценку показателей крови2 с последующей их оптимизацией
- При лечении анемии до операции за целевое значение концентрации гемоглобина (Hb) следует принимать 130 г/л и более для обоих полов, чтобы минимизировать риск неблагоприятных исходов, связанных с гемотрансфузиями.
- Концентрация сывороточного ферритина (СФ) более 30 мкг/л является наиболее чувствительным и специфическим тестом, используемым для выявления абсолютного ДЖ. Однако при наличии воспалительного процесса [С-реактивный белок (С-РБ) более 5 мг/л] и коэффициенте насыщения трансферрина железом (НТЖ) менее 20% о ДЖ свидетельствует концентрация СФ менее 100 мкг/л.
- Заместительная терапия пероральными препаратами железа подходит пациентам с ДЖ с анемией или без нее, с плановым оперативным вмешательством более чем через 6 недель после установления диагноза; проводится преимущественно врачом первичного амбулаторного звена (врачом общей практики).
- Внутривенные препараты железа следует использовать в качестве первой линии терапии у пациентов c недостаточным ответом на пероральные препараты железа или с их непереносимостью, а также, если операция планируется менее чем через 6 недель после установления диагноза.
| Специальность | Хирургическое вмешательство |
|---|---|
| Кардиоторакальная хирургия |
Протезирование клапанов сердца Повторное аортокоронарное шунтирование Протезирование при аневризме дуги аорты Аортокоронарное шунтирование Сочетанная операция аортокоронарного шунтирования с вмешательством на клапанах Пневмонэктомия/лобэктомия Повторная операция с открытием грудной клетки |
| Ортопедия |
Спондилосинтез (более двух уровней) Протезирование коленного сустава Протезирование тазобедренного сустава Перелом таза Поверхностное протезирование суставов Переломы длинных костей нижних конечностей |
| Урология |
Радикальная позадилонная простатэктомия (кроме роботизированной простатэктомии) Цистэктомия Нефрэктомия |
| Нейрохирургия |
Гигантская аневризма базилярной артерии Аневризма сосуда головного мозга |
| Акушерство/гинекология |
Беременность с высоким риском Миомэктомия (без эмболизации) Аномалии инвазии плаценты Абдоминальная гистерэктомия при увеличенной матке |
| Пластическая хирургия |
Уменьшение/реконструкция молочной железы Пересадка крупных участков кожи Абдоминопластика |
| Сосудистая хирургия |
Вмешательство по поводу аневризмы торакоабдоминального отдела аорты Аортобифеморальное шунтирование Аксилофеморальное шунтирование Операции по поводу аневризмы брюшной аорты Реваскуляризация нижних конечностей |
| Общая хирургия |
Резекция печени (без эмболизации) Операция Випла Спленэктомия Любая открытая абдоминальная операция Колонэктомия/резекция кишки |
| Онкология |
Любые открытые операции на легких и органах средостения по поводу злокачественных новообразований, резекция и экстирпация пищевода с различной пластикой, субтотальные резекции желудка, гастроэктомия с лимфодиссекцией, панкреатодуоденальная резекция, левосторонняя и правосторонняя гемигепатэктомия, операции на забрюшинном пространстве при различных злокачественных новообразованиях, экстирпация матки с придатками с тазовой лимфаденэктомией и без нее, расширенная экстирпация матки с придатками (операция Вертгейма), эвисцерация органов малого таза, брюшно-промежностная экстирпация прямой кишки по Кеню-Майлсу, реконструктивно-пластические вмешательства на органах малого таза при злокачественных новобразованиях, межлопаточно-грудное вычленение, операции на костях таза по поводу злокачественных новообразований, эндопротезированние костей и суставов при опухолях, любые расширенные и комбинированные хирургические вмешательства на органах грудной, брюшной полостей и малого таза. |
| Другие |
Любые вмешательства у пациента, который отказывается от гемотрансфузий, даже если его жизнь в опасности |
Необходимость отсрочки
Анемия — это фактор риска развития осложнений в периоперационном периоде, поэтому анемия является противопоказанием к выполнению планового хирургического вмешательства.
Своевременное лечение ЖДА на предоперационном этапе улучшает клинические исходы, снижает потребность в объемах и частоте гемотрансфузий и сокращает продолжительность госпитализации1-3. Однако существует неопределенность относительно того, в каких случаях следует откладывать хирургическое вмешательство у пациентов с не диагностированной/не пролеченной анемией.
Подход может быть различным, в зависимости от того, назначена ли операция по поводу доброкачественного или злокачественного новообразования, является экстренной или плановой, выполняется по жизненным показаниям или нет. Перед большими операциями в связи с доброкачественными новообразованиями, особенно при ожидаемой кровопотере более 500 мл, следует проинформировать пациента о взаимосвязи между анемией, заболеваемостью и летальностью, и ему должна быть предоставлена возможность отложить плановую операцию на срок, необходимый для диагностики и лечения анемии4,5.
В некоторых руководствах рекомендуют отложить операцию примерно на 4 недели, чтобы обеспечить надлежащее лечение анемии4,6,7,8. В ряде Европейских стран допустимое время между диагностикой и хирургическим вмешательством при злокачественных новообразованиях регулируется правовыми нормами. Тем не менее, пациентам со злокачественными новообразованиями рекомендовано провести предоперационное лечение ЖДА9-11. Уровень убедительности рекомендаций I, уровень достоверности доказательств — B.
Диагностика
Лабораторные исследования обязательны для подтверждения диагноза ЖДА. Необходимо обследовать всех пациентов с анемией и предстоящими большими хирургическими вмешательствами, особенно при возможной умеренной или значительной кровопотере (более 500 мл), и/или если вероятность переливания эритроцитной массы составляет 10% и более. Лабораторные исследования в предоперационном периоде должны проводиться как можно раньше, чтобы в случае необходимости осуществить наиболее подходящее лечение.
Критерии лабораторной диагностики ЖДА
В общем анализе крови, выполненном «ручным» методом, ориентируются на снижение концентрации гемоглобина — НЬ (менее 110 г/л), небольшое снижение количества эритроцитов (менее 3,8 х И)12/л), снижение цветового показателя (менее 0,85), увеличение СОЭ (более 10–12 мм/ч), сниженное или нормальное количество ретикулоцитов (норма 10–20%с). Дополнительно врач-лаборант описывает морфологические изменения эритроцитов — анизоцитоз и пойкилоцитоз. ЖДА — это микроцитарная, гипохромная, нормо- или реже гипорегенераторная анемия.
Критерии анемии (ВОЗ)
| Гемоглобин | Эритроциты | Гематокрит | |
|---|---|---|---|
| Мужчины | менее 130 г/л | менее 4х1012 на л | менее 39% |
| Женщины | менее 120 г/л | менее 3,8х1012 на л | менее 36% |
| Беременные | менее 105–110 г/л | — | менее 33% |
| Гемоглобин | |
|---|---|
| Эритроциты | Гематокрит |
| Мужчины | менее 130 г/л |
| менее 4х1012 на л | менее 39% |
| Женщины | менее 120 г/л |
| менее 3,8х1012 на л | менее 36% |
| Беременные | менее 105–110 г/л |
| — | менее 33% |
Классификация анемии по степени тяжести (РФ)
Легкая анемия — Нb 110–90 г/л.
Анемия средней тяжести — Нb 89–70 г/л.
Тяжелая анемия — Нb менее 70 г/л.
В биохимическом анализе крови ориентируются на снижение концентрации сывороточного железа — СЖ (менее 12,5 мкмоль/л), повышение общей железосвязывающей способности сыворотки — ОЖСС (более 69 мкмоль/л), снижение
коэффициента насыщения трансферрина железом — КНТЖ (менее 17%), снижение концентрации сывороточного ферритина — СФ (менее 30 нг/мл или мкг/л).
В последние годы появилась возможность определения растворимых трансферриновых рецепторов (рТФР), концентрация которых в условиях дефицита железа увеличивается (более 2,9 мкг/мл)1.
Дифференциальная диагностика железодефицитной анемии и анемии хронических болезней2
| Показатель | Норма | ЖДА | АХБ |
|---|---|---|---|
| Наличие хронических заболеваний | Нет | Есть | |
| СЖ | <12,5 мкмоль/л | ||
| ОЖСС | <69 мкмоль/л | N или |
|
| ПТЖ | >17% | N | |
| СФ | >30 нг/мл | N или |
|
| ПТЖ | 2,9 нг/мл | N |
| Показатель | Норма |
|---|---|
| Наличие хронических заболеваний | |
| СЖ | <12,5 мкмоль/л |
| ОЖСС | <69 мкмоль/л |
| ПТЖ | >17% |
| СФ | >30 нг/мл |
| ПТЖ | 2,9 нг/мл |
| ЖДА | АХБ |
| Нет | Есть |
| N или |
|
| N | |
| N или |
|
| N |
N — нормальное значение,![]() — повышение показателя,
— повышение показателя,![]() — понижение показателя.
— понижение показателя.
Также необходимо определение маркеров воспаления (С-РБ) и почечной функции (сывороточный креатинин). Данные анализы могут быть назначены хирургом (при консультации пациента и решения вопроса об оперативном лечении), анестезиологом (при осмотре перед анестезией) или врачом амбулаторного звена/врачом общей практики3.
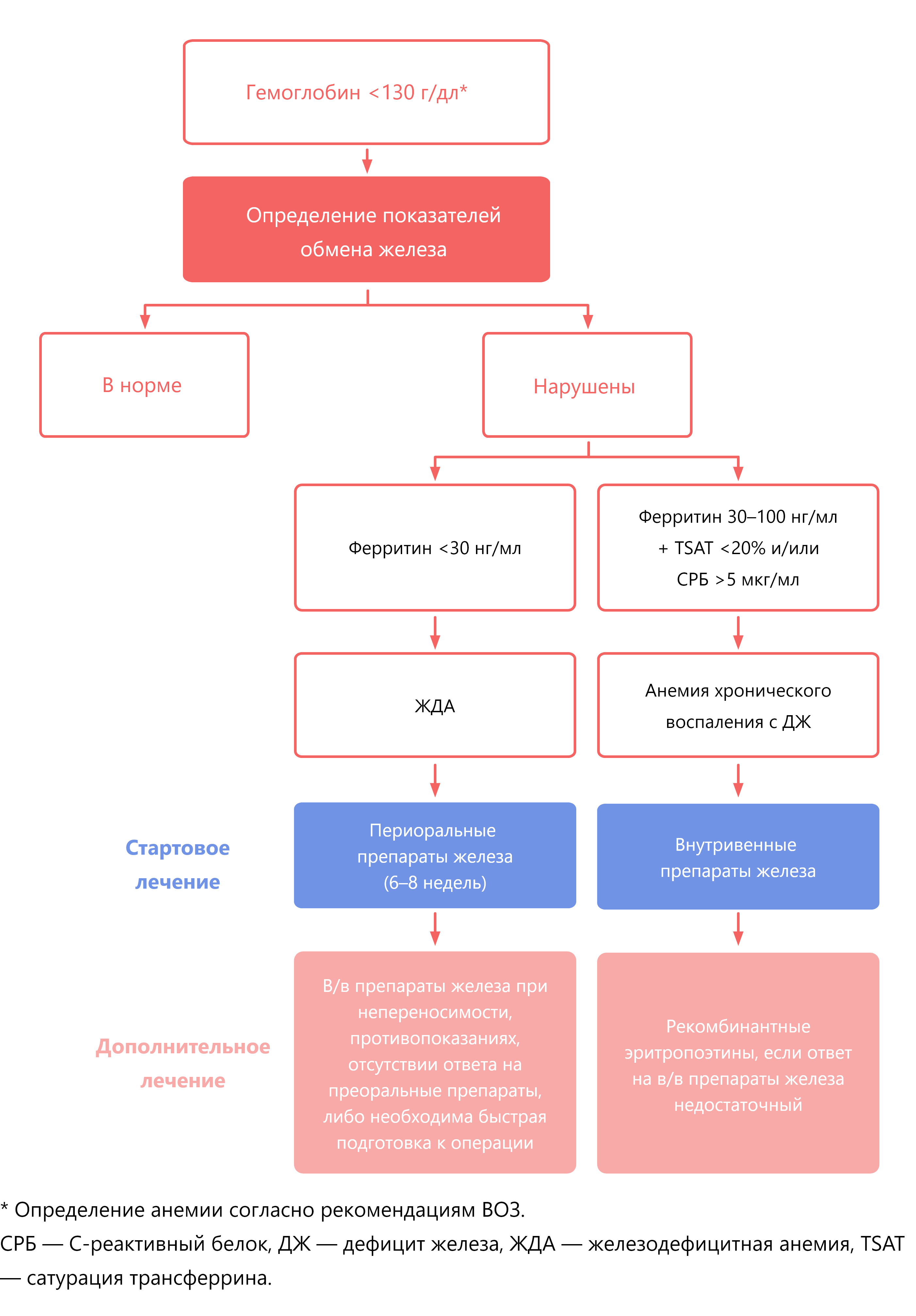
Алгоритм ведения пациентов с анемией перед плановым хирургическим вмешательством на этапе ПМСП4.
Диагностика и терапия ЖДА3
Рекомендации по классификации и стартовому или дополнительному лечению периоперационной анемии.
Лечение
Лечение предоперационной ЖДА следует проводить как можно раньше перед запланированным хирургическим вмешательством.
Большинство больших хирургических операций является плановыми. Недавно проведенный аудит Службы крови и трансплантатов Национальной службы здравоохранения (National Health Service — NHS) Великобритании показал, что от момента записи пациента на операцию до самой операции в среднем проходит 60 дней1. Таким образом, лечение ЖДА следует проводить в то время, пока пациент находится в листе ожидания хирургического вмешательства, хотя в настоящее время это практикуется редко2. Уровень убедительности рекомендаций I, уровень достоверности доказательств — С.
В руководствах Европейского общества анестезиологов и Health Quality Ontario рекомендуется лечить анемию до операции с целью достижения уровня гемоглобина более 120 г/л. При этом, в зависимости от сроков до операции, переносимости перорального железа и показателей крови, предпочтение следует отдать внутривенным препаратам железа3.
В результате мета-анализа данных 21 исследования, проведенных в различных клинических условиях, было сделано заключение, что ДЖ без анемии является самостоятельным заболеванием, заслуживающим дальнейших исследований по разработке стратегии его выявления и лечения4. Пациентам без анемии, с ДЖ или недостаточными запасами железа в депо, которым предстоят хирургические вмешательства с ожидаемой умеренной или большой кровопотерей, может быть назначено предоперационное введение препаратов железа, чтобы ускорить восстановление в послеоперационном периоде5,6. Пациентам с абсолютным ДЖ (СФ менее 30 мкг/л) рекомендуется исключить патологию ЖКТ. При микроцитозе вследствие ДЖ без анемии пациенту следует провести обследование на предмет выявления хронической гипоксемии, миелопролиферативного заболевания (например, истинная красная полицитемия) или другой причины увеличения продукции эритроцитов. Введение железа у таких больных может вызвать резкое повышение концентрации Hb, что может привести к повышению вязкости крови3.
Cроки до операции
Если операция планируется менее чем через 6 недель, внутривенное введение препаратов железа является наиболее эффективным вариантом терапии. Внутривенное введение препаратов железа высокоэффективно для пополнения запасов железа и повышения концентрации Hb при ЖДА с воспалением или без него. Уровень убедительности рекомендаций I, уровень достоверности доказательств — B3.
Однако в российской реальности диагноз анемии в большинстве случаев выставляется, когда пациент приступает к комплексному предоперационному обследованию, т.е. за 1–2 недели до запланированной даты госпитализации. И, поскольку клиническая и/или организационная ситуации зачастую не позволяют перенести сроки операции, коррекцию дефицита железа/анемии проводят непосредственно в стационаре, практикуя внутривенное введение того или иного железосодержащего комплекса, позволяющего за несколько инфузий ввести расчетную курсовую дозу железа и повысить концентрацию гемоглобина7.
Терапия внутривенными препаратами железа менее чем за 2 недели до операции также приводила к снижению потребности в переливании эритроцитной массы, частоты острого повреждения почек, времени пребывания в стационаре и инфекционных осложнений после ортопедических и кардиохирургических операций8-10. Уровень убедительности рекомендаций I, уровень достоверности доказательств — В3.
Внутривенные препараты железа
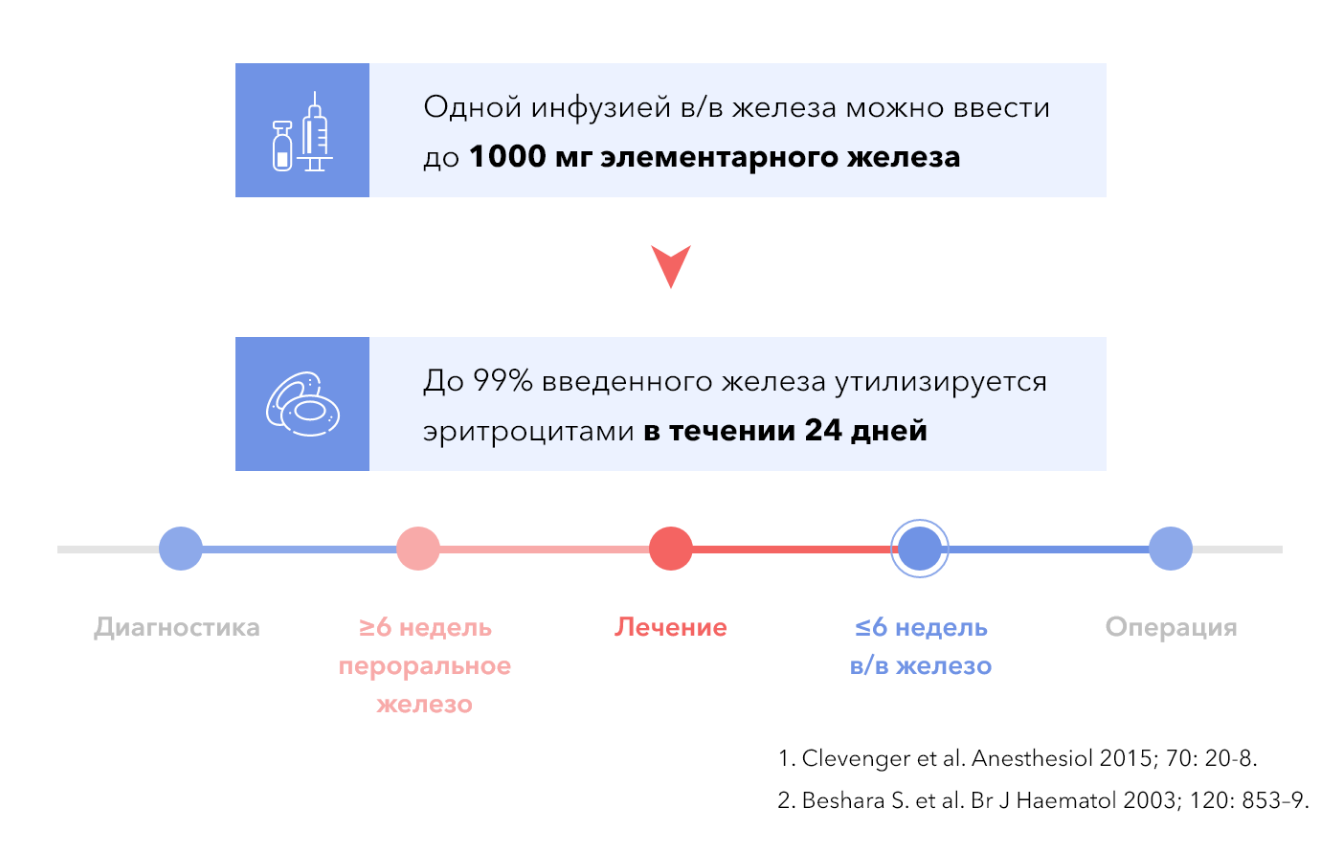
Дозу внутривенного препарата железа можно рассчитать, исходя из исходной и целевой концентрации Hb и массы тела пациента, добавив 500 мг для создания запасов железа (у пациентов с массой тела более 35 кг)11,12. Таким образом, рассчитывается общий ДЖ в организме. На практике 1000–1500 мг является достаточной дозой для большинства пациентов, может вводиться путем медленной инфузии в течение менее чем 1 ч за одну процедуру или двумя раздельными дозами, в зависимости от используемого препарата. У большинства пациентов отмечается улучшение самочувствия через 3 дня с быстрым ответом в виде повышения концентрации Hb (у 50% пациентов через 5 дней, у 75% пациентов через 10–14 дней, максимально к 3-й неделе)13. На маленьких выборках у пациентов перед ортопедическими операциями была показана эффективность внутривенного введения сахарозного комплекса железа для лечения ЖДА с максимальным повышением концентрации Hb через 2 недели14. В абдоминальной хирургии внутривенное введение железа карбоксимальтозата (1000 мг) за 2–4 недели или 8–10 дней до операции снижало потребность в переливании эритроцитной массы и продолжительность госпитализации15,16. По данным Кокрановской библиотеки, именно карбоксимальтозат железа является препаратом выбора для лечения ЖДА в предоперационном периоде17. Уровень убедительности рекомендаций I, уровень достоверности доказательств — B.
Важно выявлять и лечить ЖДА как можно раньше перед оперативным вмешательством3,5,18
- В/в железо более эффективно в повышении уровня Hb, чем пероральные препараты3.
- В/в железо обеспечивает быстрое восполнение запасов железа3.
- Отсутствие проблем с приверженностью к лечению3.
У женщин, перенесших серьезные внесердечные хирургические операции, истинный ДЖ (СФ менее 30 мкг/л) наблюдался практически одинаково часто при концентрации Hb 120–129 и менее 120 г/л, но значительно чаще, чем при концентрации Hb 130 г/л и более (42%, 51 и 24% соответственно; р < 0,05). Это также относится к недостаточному обеспечению железом эритропоэза, что было определено по снижению НТЖ менее 20% (58%, 69 и 34% соответственно; р < 0,05). Таким образом, несмотря на то, что согласно определению ВОЗ, женщины с концентрацией Hb 120–129 г/л не относятся к категории пациентов с анемией, большинству из них будет полезна заместительная терапия препаратами железа для оптимизации предоперационной концентрации Hb и для терапии постоперационной анемии.
Распространенность
Послеоперационная анемия может наблюдать у 80−90% пациентов, перенесших большую операцию1,2.
В соответствии с рекомендациями ВОЗ послеоперационная анемия классифицируется по степени тяжести следующим образом: легкая (Hb 110–119 г/л у женщин и 110–129 г/л у мужчин), средней тяжести (Hb 80–109 г/л) и тяжелая (Hb менее 80 г/л)3.
Несмотря на многофакторность, анемия до операции, периоперационная кровопотеря (кровопотеря во время хирургического вмешательства, коагулопатия, забор крови из вены и т.д.) и послеоперационное нарушение эритропоэза являются основными факторами, способствующими развитию послеоперационной анемии после больших операций. Инфузионная терапия, которая может вызвать анемию за счет гемодилюции или усугубить уже существующую анемию, дефицит других микроэлементов и витаминов (например, витамина B12, фолиевой кислоты) и лекарственное взаимодействие также способствуют развитию анемии4.
Низкая концентрация Hb до операции, женский пол и меньшая площадь поверхности тела были определены как факторы риска развития послеоперационной анемии и повышенной потребности в гемотрансфузиях5. Кроме того, в общей популяции распространенность анемии увеличивается с возрастом; пожилые люди чаще нуждаются в проведении больших операций и имеют сопутствующие заболевания, что повышает риск развития послеоперационной анемии и снижает ее переносимость6,7.
Также повышенная концентрация гепцидина из-за воспалительного ответа на хирургическое вмешательство может привести к ингибированию всасывания железа из тонкой кишки и уменьшению поступления железа из запасов (секвестрация железа)8. Эти эффекты могут длиться в течение нескольких недель после большой операции и усугубить послеоперационную ЖДА.
Последствия
Послеоперационная анемия потенциально может влиять на выздоровление, реабилитацию, повторную госпитализацию и повторную операцию, а также состояние пациента.
Уменьшение гемотрансфузий улучшает отдаленные результаты и повышает выживаемость1. Однако применение протоколов с более низкой концентрацией Hb в качестве показания к гемотрансфузиям привело к тому, что пациентов стали выписывать с более низкой, чем раньше концентрацией Hb.
Было проведено небольшое количество исследований, посвященных изучению последствий послеоперационной анемии на этапе восстановления после операции, в частности клинические исследования после операций на сердце и после замены коленного и тазобедренного суставов, в ходе которых была доказана связь между послеоперационной анемией и неблагоприятными исходами, такими как длительное выздоровление, повышенная летальность и вероятность повторной госпитализации2–4. Послеоперационная анемия также может быть потенциально связана с развитием в ранние сроки после операции инфакта миокарда5.
Необходимость коррекции до выписки
В последние годы в клинической практике превалирует рестриктивная политика в отношении переливания донорской эритроцитной массы. Национальный институт охраны здоровья и совершенствования медицинской помощи и другие международные и российские ассоциации в своих руководствах1‒7 снизили порог донорских гемотрансфузий для хирургических больных до 70 г/л и до 80 г/л для пациентов с ишемической болезнью сердца в анамнезе при отсутствии активного кровотечения. В связи с этим в послеоперационном периоде у хирургических пациентов необходимо проводить лечение анемии и ДЖ.
Рекомендации
Рекомендации для лучшей клинической практики: основные положения1.
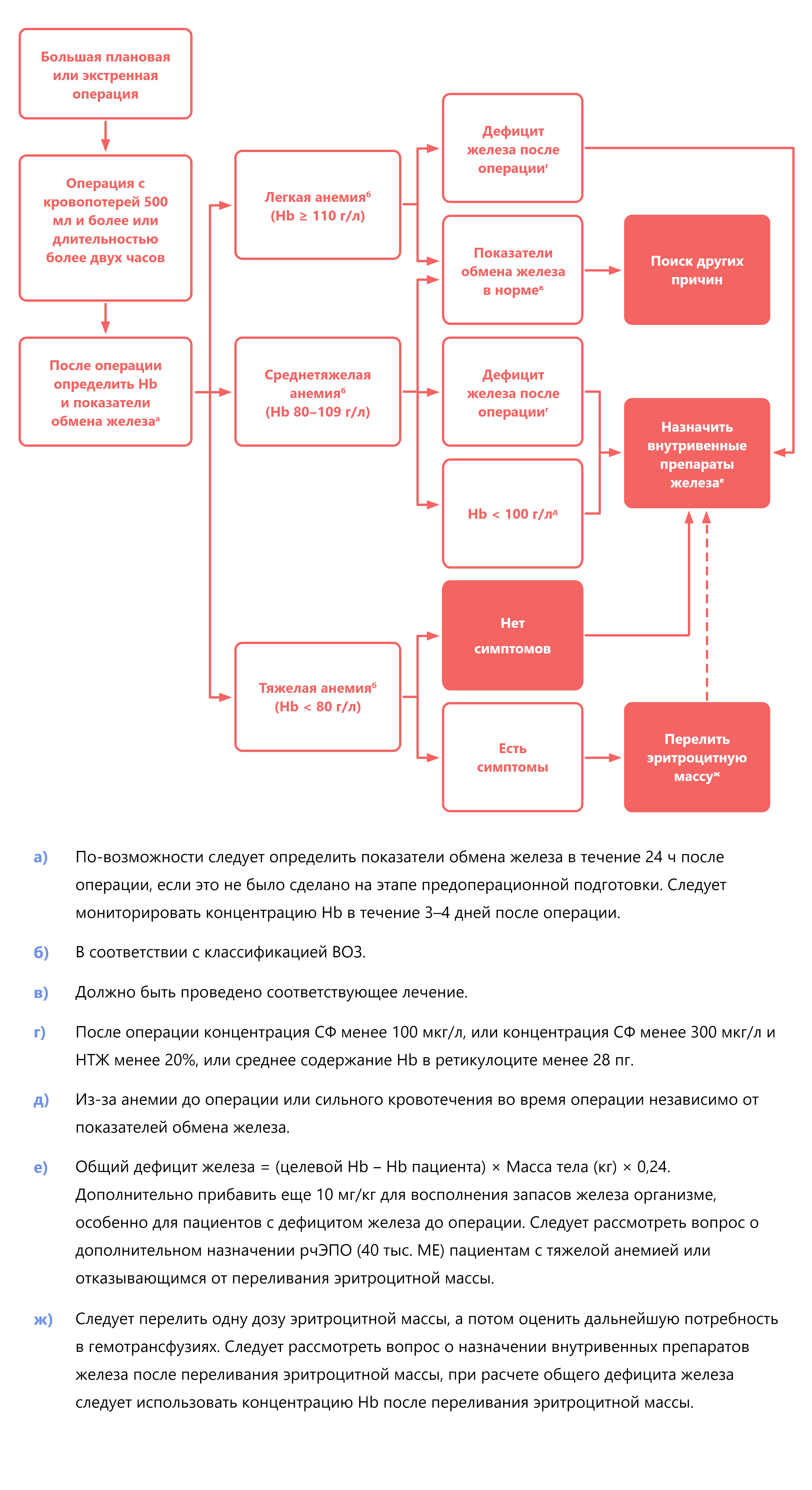
- Все пациенты, которым была выполнена большая операция (кровопотеря более 500 мл или операция продолжительностью более двух часов) и у которых была анемия до операции или у которых была среднетяжелая или тяжелая кровопотеря во время операции, должны быть обследованы на предмет выявления анемии после операции.
- Для выявления анемии во время восстановления после неосложненной большой операции концентрацию гемоглобина (Hb) следует контролировать ежедневно либо в общебольничной лаборатории, либо у постели больного, по крайней мере, до третьего дня после операции (у мужчин за анемию принимают Hb менее 130 г/л, у женщин — менее 120 г/л).
- В послеоперационном периоде за дефицит железа принимают концентрацию сывороточного ферритина (СФ) менее 100 мкг/л, или концентрацию СФ менее 100–300 мкг/л и коэффициент насыщения трансферрина железом (НТЖ) менее 20%, или среднее содержание Hb в ретикулоците менее 28 пг. Тяжелая кровопотеря во время операции может также указывать на необходимость восполнения запасов железа у пациентов с анемией.
- Неонкологическим пациентам с тяжелой послеоперационной анемией и нарушенным эритропоэзом вследствие воспаления или тем пациентам, которые отказываются от гемотрансфузий, мы предлагаем дополнительно назначать эритропоэзстимулирующие агенты.
- Если с помощью предпринятых мер не удалось предотвратить развитие тяжелой послеоперационной анемии, то большинству взрослых пациентов, находящихся в стационаре в стабильном состоянии, рекомендуется перелить эритроцитную массу (показанием для гемотрансфузии является концентрация Hb менее 70–80 г/л в зависимости от наличия сопутствующих заболеваний).
Диагностика
Когда и как определять концентрацию Hb?
Определение концентрации Hb является рутинной процедурой в послеоперационном периоде. В большинстве случаев неосложненного течения послеоперационного периода самая низкая концентрация Hb наблюдается в первые 3–4 дня после операции. Однако пациенты с серьезными осложнениями после большой операции, длительно находящиеся в стационаре и с низкой концентацией Hb нуждаются в длительном мониторинге. Как правило, у постели больного делают анализ газового состава крови и измеряют концентрацию Hb в капилляроной крови с помощью специальных систем (например, HemoCue, HemoCue AB, Ängelholm, Швеция) или определяют уровень оксигенации Hb с помощью ближней инфракрасной спектроскопии (например, Radical-67, Masimo Corporation, Ирвайн, штат Калифорния, США), а общий анализ крови выполняют в центральной лаборатории. Использование неинвазивных методов для постоянного мониторинга концентрации Hb вместо забора крови из вены может уменьшить потери крови, болезненные ощущения и дискомфорт для пациента, однако опасения на счет точности этих методов ограничивают их использование в клинической практике1.
Какие факторы мешают точному определению концентрации Hb?
В послеоперационном периоде ряд факторов могут влиять на точное определение концентрации Hb. Перегрузка объемом жидкости и гемодилюция после большой операции являются возможными причинами снижения концентрации Hb, несмотря на нормальное и стабильное количество эритроцитов. Таким образом, диагноз анемии, основанный на простом определении концентрации Hb, может быть ошибочным, и его путают с увеличением объема плазмы, что приводит к значительной гипердиагностике анемии2. Следует принимать в расчет потенциально возможную перегрузку объемом жидкости, которая может уменьшиться после повышения диуреза.
Диагностика или количественная оценка снижения объема циркулирующей крови (тяжести острой кровопотери) и чувствительности организма к этому остается сложной задачей и может быть решена с помощью определения лабораторных показателей, таких как концентрация лактата и буферных оснований, изменения положения тела (приподнятого положения ног), новых устройств для мониторинга (измерение пульсового давления и индекса ударного объема или других показателей) или эхокардиографии. В последних руководствах подчеркивается важность предотвращения гиперволемии3. Во время послеоперационного восстановления перераспределение и выведение жидкости может привести к быстрому повышению концентрации Hb, снижение которой было вызвано гемодилюцией.
Когда и как определять послеоперационный дефицит железа?
Хотя послеоперационная анемия имеет многофакторную природу, дефицит железа часто присутствует. Несмотря на то, что дефицит железа до операции может быть выявлен на основании низкой концентрации СФ4, диагностика послеоперационного дефицита железа представляется более сложной задачей, поскольку концентрация СФ может быть повышена в ответ на острое воспаление после операции5. Поэтому у пациентов, которым выполняются большие операции и которые имеют высокий риск развития среднетяжелой или тяжелой послеоперационной анемии, следует определять концентрацию Hb и показатели обмена железа в день операции, если это не было сделано во время предоперационной подготовки. Это также может относиться к пациентам с продолжающимся кровотечением и анемией (например, пациентам с колоректальным раком), которые получали лечение в предоперационном периоде. Поскольку концентрация СФ не повышается за счет воспаления сразу же после операции, концентрация СФ более 100 мкг/л в течение 24 часов после операции указывает на недостаточные запасы железа в организме для поддержания эритропоэза, что может привести к значительному снижению концентрации Hb после операции6.
Другими маркерами послеоперационного дефицита железа являются НТЖ менее 20% при концентрации СФ 100–300 мкг/л. Такие значения указанных показателей могут свидетельствовать о необходимости лечения пациентов с анемией5,7–9.
Лечение
Лекарственная коррекция концентрации Hb и эритропоэза должна помочь устранить дефицит железа и обеспечить быстрое выздоровление от послеоперационной анемии, что может привести к улучшению результатов послеоперационного периода и качества жизни. Она также может привести к уменьшению гемотрансфузий и связанных с ними рисков и осложнений, что будет способствовать дальнейшему улучшению результатов операции и безопасности пациентов1.
Лечение ДЖ пероральными препаратами железа в ближайшем послеоперационном периоде играет ограниченную роль вследствие плохого всасывания и значительных нежелательных явлений и не рекомендуется2. Напротив, внутривенные препараты железа были успешно использованы для лечения ЖДА после операции по поводу артропластики нижних конечностей3, гастроэктомии4 и послеродового кровотечения5. Внутривенное введение однократной дозы 1000 мг железа карбоксимальтозата после больших ортопедических, абдоминальных, урогенитальных и других операций способно скорректировать анемию и улучшить качество жизни по сравнению с применением пероральных препаратов железа6. Уровень убедительности рекомендаций I, уровень достоверности доказательств — В.
Следовательно, при необходимости лечения послеоперационной анемии следует назначать внутривенные препараты железа. При расчете общей дозы железа следует учитывать концентрацию Hb и показатели обмена железа до операции, величину снижения концентрации Hb после операции и то, получал ли пациент переливание эритроцитной массы после операции (см. рисунок).
Лечение послеоперационной анемии.
Использование внутривенных препаратов железа, которые позволяют быстро (за 15–30 мин.) ввести большую дозу железа (1000 мг или более), создает дополнительное удобство как для врача, так и для пациента, и должно быть предпочтительным.
Трансфузионный пакет с эритроцитной массой содержит гемовое железо (200–250 мг в одном пакете), а также небольшое количество лабильного железа, которое немедленно доступно для эритропоэза (это частично зависит от времени хранения донорских компонентов крови до трансфузии)7. После переливания одной дозы эритроцитной массы концентрация Hb возрастает в среднем на 10 г/л. Коррекция послеоперационного ДЖ, в дополнение к переливанию эритроцитной массы для повышения концентрации Hb, имеет важное значение. Сегодня возможно одновременное использование внутривенных препаратов железа и эритропоэзстимулирующих агентов. Уровень убедительности рекомендаций I, уровень достоверности доказательств — В.